用糖苷酶编辑治疗性蛋白质上的糖链
什么是蛋白质糖基化
真核生物蛋白质最常见的翻译后修饰之一是糖基化。蛋白质的糖基化可以影响许多生物活性。对于治疗性糖蛋白,它可以改变生物活性、靶向性、转运、血清半衰期、清除性和受体的识别[1,2]。出于这样的原因,生物制造厂商必须监测和表征他们的重组治疗蛋白的糖基化模式>[3,4]。治疗蛋白有两种主要的糖基化类型:N-连接的糖链和O-连接的糖链[5]。N-糖链的附着始于内质网(ER),在内质网中,核心的新生多糖通过蛋白质的特定天冬酰胺(产品号:F141104)残基上的侧链酰胺氮连接在具有NXS/T序列的位置,其中X可以是除脯氨酸(产品号:P111001)以外的任何氨基酸残基。当糖蛋白通过内质网和高尔基体时,N-糖链被修剪和进一步修饰。宿主细胞和细胞培养条件可以改变糖蛋白上存在的N-糖基化类型(从高甘露糖到复杂和杂交的N-糖链)。O-糖基化发生在高尔基体中。N-葡聚糖有一个共同的核心,由两个N-乙酰氨基葡萄糖(产品号:N355747)(GlcNAc)残基和三个甘露糖(Man)残基组成。但O-葡聚糖唯一的共同核心是N-乙酰半乳糖胺(产品号:N389642)(GalNAc)残基,它通过蛋白质的丝氨酸(产品号:S329534)或苏氨酸残基的侧链上的氧原子连接。
糖苷酶:糖基化是复杂的和异质性的,所以必须使用多种分析方法来确定糖链的结构和它们在糖蛋白上的位置。糖苷酶是重要的工具,通常与其他分析方法一起使用,以去除、修剪或修饰多糖。糖苷酶(糖苷水解酶)(产品号:G128643、N159659、A109181)是一种能分解复合糖的糖苷键的酶。这些酶应用于治疗性糖蛋白的三个主要分析领域:去除用于分析的葡聚糖、修剪用于测序的葡聚糖和在糖工程中修饰葡聚糖。在这里,我们描述了在每个领域中使用的不同的酶,以及它们的应用的具体例子。
提取用于分析的多聚糖
从糖蛋白中去除N-糖链最常用的酶是多肽-N-糖苷酶F(PNGase F)(产品号:P420186)。它是一种酰胺酶,在N-糖链最里面的GlcNAc残基和天冬酰胺残基之间裂解,释放N-糖链,从而在蛋白质上产生天冬氨酸(产品号:A329587)残基而不是天冬酰胺残基。糖苷酶如此频繁使用的一个主要原因是它们具有非常广泛的特异性,可以裂解高甘露糖、复杂的和混合的N-糖链。这种酶的唯一限制是,如果有α1-3岩藻糖连接到核心GlcNAc残基(蛋白质旁边的糖残基),就不能切割。这种修饰只发生在植物、昆虫、软体动物和寄生蠕虫中。含有这种修饰的N-葡聚糖可以被PNGase A酶去除。一旦N-葡聚糖被酰胺酶释放,就可以对其进行流动标记,以供液相色谱-荧光检测(LC-FLD)或质谱(LC-MS)或毛细管电泳联用激光诱导荧光检测(CE-LIF)分析。图1说明了PNGase F从Erbitux治疗性抗体(西妥昔单抗)中释放的N-糖链的种类,并通过LC-MS分析进行了检测。
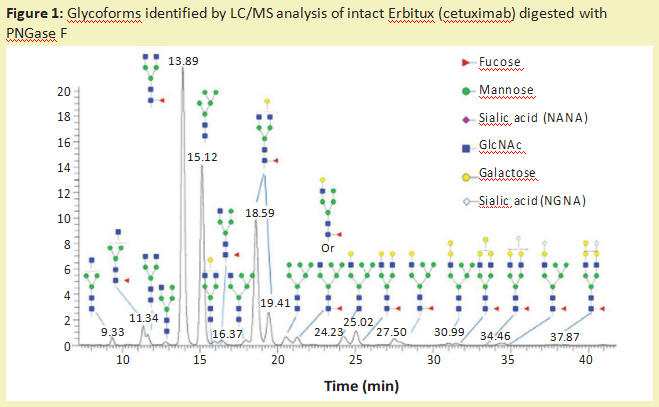
除了PNGase F,许多不同的内切-β-N-乙酰氨基葡萄糖苷酶也从糖蛋白中释放N-糖链。大多数内切糖苷酶仅限于它们能识别和切割的N-糖链类型。表1显示了大多数商业上可获得的内切-β-N乙酰氨基葡萄糖苷酶的不同特性。所有这些内切糖苷酶都能水解N,N’二乙酰壳寡糖部分(位于N-糖核上的两个GlcNAc残基之间),使GlcNAc残基附着在蛋白质上。因此,它们经常被用来确定N-聚糖在特定部位的占有率或存在情况。这对具有多个N-糖基化位点的糖蛋白特别有用。
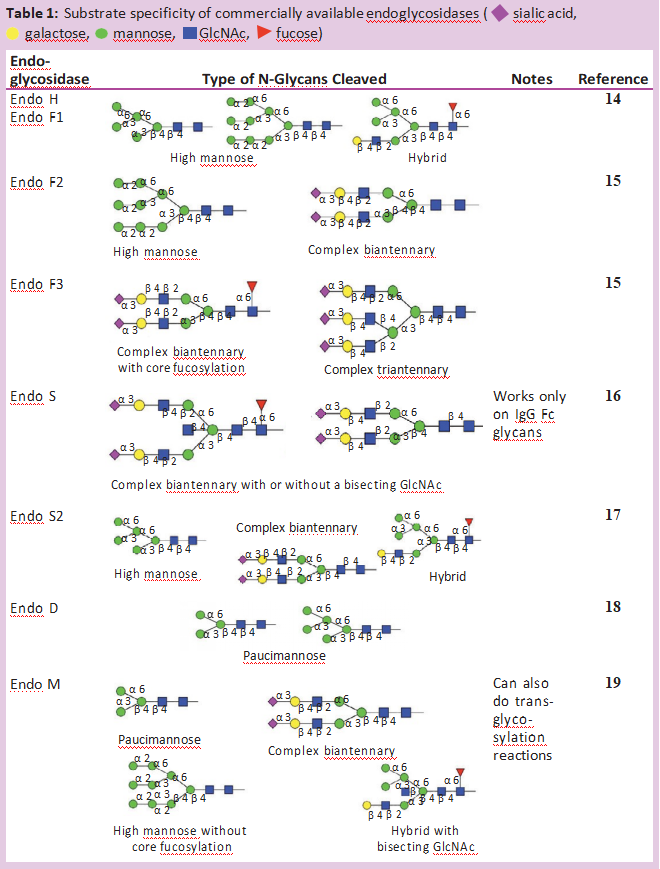
通常情况下,糖蛋白先用内切糖苷酶消化,然后用蛋白酶(产品号:P298993)裂解。然后用MS分析这些多肽片段。任何肽片段上单个GlcNAc残基的额外质量证实该位置被N-糖链占据[6]。由于内切-β-N-乙酰氨基葡萄糖苷酶的水解点远离蛋白质骨架,因此在非变性条件下,这些酶通常能裂解N-糖链。即使这些位点在相似的自然条件下不能切割PNGase F,也会发生这种情况。对于Endo S尤其如此,它专用于对免疫球蛋白Fc区N-糖链的水解,并且偏爱非变性条件。当目标是保存蛋白质的结构时,这种内切糖苷酶在自然条件下水解糖的能力特别强。
目前,还没有已知的广谱特异性内切糖苷酶能将所有O-糖链从糖蛋白中分离出来。因此,O-糖链的分析比N-糖链的分析要困难得多。有两种O-糖苷酶可以在市场上买到。一种来自肺炎链球菌,可以释放核心1二糖,由连接β1-3的半乳糖(Gal)和N-乙酰半乳糖胺(GalNAc)组成,其中GalNAc残基与蛋白质的丝氨酸或苏氨酸(产品号:T108221、T100459)残基相连[7]。另一种O-糖苷酶来自粪肠球菌,具有稍宽的专一性,将核心1二糖和核心3二糖都裂解,其中核心3二糖由β1-3连接到GalNAc[8]。如果双糖被唾液酸或其他糖进一步修饰,两种酶都不能裂解。使用β消除法可以化学释放完整的O-葡聚糖,但必须注意这种方法不能降解释放的葡聚糖(产品号:D140049等)。
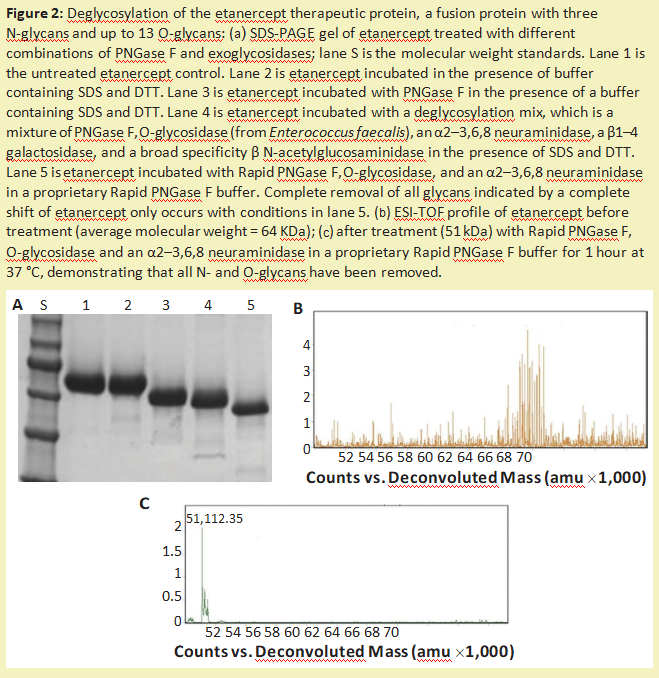
这种方法的另一个主要缺点是蛋白质被破坏,不能再分析其结构或活性。与O-葡聚糖的完整化学释放相比,可以使用外切糖苷酶和O-糖苷酶的组合来修剪O-葡聚糖(图2)。虽然这种方法可以保留蛋白质的结构和活性,但它会降解多糖,因此无法对其进行表征。此外,一些O-葡聚糖含有糖类修饰(例如,硫化或乙酰化),使修饰后的糖不被外切糖苷酶切割。
修剪糖链以进行测序
胞外糖苷酶是一种重要的酶,它可以一次一个糖残留物地将多聚糖从多聚糖的非还原末端去除。商业上有大量不同的外切糖苷酶。胞外糖苷酶对糖的类型及其异构体(α或β)都是特异的。一些外切糖苷酶比较普遍,可以分解许多不同的连接。例如,广特异性神经氨酸酶(产品号:N128387)可以去除连接到糖链上的α2-3、α2-6、α2-8或α2-9上的唾液酸残基。其他外切糖苷酶对特定的连锁更具专一性。例如,β1-4半乳糖苷酶只能去除β1-4连接的半乳糖。由于这些酶的先天专一性,外切糖苷酶对修剪糖链和确定糖链的序列都很有用。基本的LC-MS或基质辅助激光解吸/电离(MALDI)分析只能确定多糖的大小。然而,为了确定多糖上存在的单糖的连接或类型,有必要进行串联质谱仪(MS-MS),例如碰撞诱导解离(CID)或使用外切糖苷酶,然后进行CE或MS分析。
当使用外切糖苷酶时,重要的是要考虑酶制剂的质量。从天然来源分离的酶制剂往往会被其他糖苷酶活性污染,这使得多糖结构的阐明变得更加困难。最常用的外切糖苷酶的重组测序级版本现在可以在商业上用于敏感的葡聚糖分析工作流程。
图3显示了糖苷酶如何对从Enbrel治疗蛋白(依那西普)释放的多糖进行测序。胞外糖苷酶也可以用来对仍然附着在糖蛋白上的糖链进行测序。这些酶对于分析和检测糖链上潜在的抗原结构特别有用。例如,使用通用的α-半乳糖苷酶,如来自绿咖啡豆的酶来处理治疗性蛋白质,可以帮助识别低水平的半乳糖α1-3Gal(α半乳糖表位),这些半乳糖苷酶在人类中不存在,并且可以产生免疫原性[9]。

葡聚糖的改性
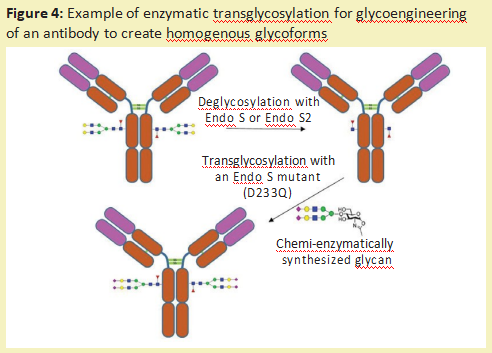
除了去除完整的糖链和进行糖链测序外,糖苷酶还可用于修饰糖蛋白上的糖链[10](称为糖工程)。一种方法是使用内切糖苷酶去除不需要的N-连接的多糖。然后,通过内切糖苷酶裂解留下的GlcNAc残基,可以将通过化学酶合成产生的所需的均匀的葡聚糖连接到糖蛋白上。可以使用内切糖苷酶(自然地转糖基化),如Endo-M[11],或使用内切糖苷酶突变体来实现所需的葡聚糖的连接,该酶突变体可以驱动反应朝向添加糖而不是去除糖的方向发展[12](图4)。
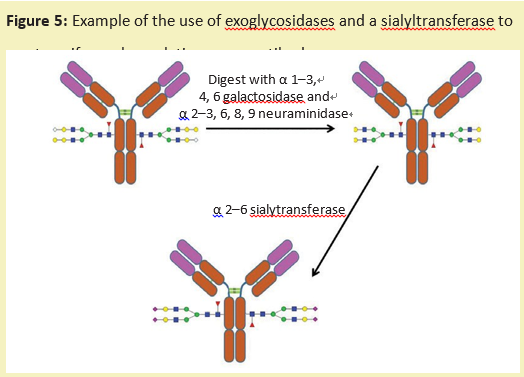
糖工程的另一种方法是使用外切糖苷酶将糖蛋白上的糖链修剪成统一的大小。然后,可以使用特定的糖基转移酶(产品号:G293642)来重建这种多糖,这种转移酶将单糖从核苷酸糖供体转移到糖链上。这会产生一种糖蛋白,具有更均一的糖链结构(图5)。
未来的应用
到目前为止,这些体外糖工程方法大多是小规模使用的。用于治疗溶酶体储存疾病的糖蛋白酶是个例外。这些酶中的几种已经被糖工程利用外糖苷酶暴露蛋白质上的甘露糖结构,以通过受体介导的内吞作用改善酶向溶酶体的运输[13]。此外,宿主细胞中糖基化途径的修饰正被用于生产具有所需糖基化的治疗性蛋白质。这些细胞系的治疗性蛋白质生产正在顺利进行,有几种治疗性蛋白质正在进行临床试验。科学家们预计,随着对高通量方法的需求增加,葡聚糖分析的速度和简单性将随着酶和分析的进一步改进而进步。新的抗体特异性蛋白水解酶,如IDES和IDEZ,是对典型的抗体胰酶/溶菌酶C或木瓜酶(产品号:P128675、P128674)消化抗体的改进,因为它们特异性地切割在抗体的铰链区域,而不是次级位点切割。使用这些酶和改进的软件,可以对抗体的恒定区进行MS分析。这使得能够确定FC上存在的多糖的类型,而不需要移除、纯化和标记N-聚糖。其他方面的改进可能会导致发现新的酶特异性。例如,一种对复杂O-葡聚糖具有广泛专一性的酶可以更好地分析这些类型的蛋白质修饰。随着更多的治疗性蛋白在转基因植物和昆虫细胞系中表达,可以去除所有N-糖链的PNGase将非常有用。最后,随着葡聚糖分析方法变得更精细,更高的吞吐量和更高的灵敏度,在开发过程中应该可以选择克隆,或者使用选择的糖工程表达宿主来产生具有所需糖基化模式的抗体。这样的速度和灵敏度还将允许对发酵过程进行持续监测,这将提高治疗性糖蛋白的生产。
参考文献:
1. Ohtsubo K,Marth JD.Glycosylation in Cellular Mechanisms of Health and Disease.Cell 126(5)2006:855–867;doi:10.1016/j.cell.2006.08.019
2. Walsh G.Posttranslational Modifications of Protein Biopharmaceuticals.Drug Discovery Today 15(17–18),2010:773–780;doi:10.1016/j.drudis.2010.06.009.
3. Beck A,et al.Trends in Glycosylation,Glycoanalysis,and Glycoengineering of Therapeutic Antibodies and Fc-Fusion Proteins.Curr.Pharm.Biotechnol.9(6),2008:482–501.
4. Sethuraman N,Stadheim TA.Challenges in Therapeutic Glycoprotein Production.Curr.Op.Biotech.17(4)2006:341–346;doi:10.1016/j.copbio.2006.06.010.
5. Spiro RG.Protein Glycosylation:Nature,Distribution,Enzymatic Formation,and Disease Implications of Glycopeptide Bonds.Glycobiology 12(4)2002:43R–56R.
6. Wang L,et al.Structural Analysis of a Highly Glycosylated and Unliganded gp120-Based Antigen Using Mass Spectrometry.Biochem.49,2010:9032–9045;doi:10.1021/bi1011332.
7. Fujita K,et al.Identification and Molecular Cloning of a Novel Glycoside Hydrolase Family of Core 1 Type O-Glycan-Specific Endo-Alpha-N-Acetylgalacto-saminidase from Bifidobacterium longum.J.Biol.Chem.280(45)2005:37415–37422;doi:10.1074/jbc.M506874200.
8. Koutsioulis D,Landry D,Guthrie EP.Novel Endo-N-Acetylgalactosaminidases with Broader Substrate Specificity.Glycobiol.18(10).2008:799–805;doi:10.1093/glycob/cwn069.
9. Bosques CJ,et al.Chinese Hamster Ovary Cells Can Produce Galactose--1,3-Galactose Antigens on Proteins.Nat.Biotechnol.28(11)2011:1153–1156;doi:10.1038/nbt1110-1153.
10. Rich JR,Withers SG.Emerging Methods for the Production of Homogeneous Human Glycoproteins.Nat.Chem.Biol.5(4)2009:206–215;doi:10.1038/nchembio.148.
11. Yamamoto K,et al.Transglycosylation Activity of Mucor hiemalis Endo-Beta-N-Acetyl-Glucosaminidase Which Transfers Complex Oligosaccharides to the N-acetylglucosamine Moieties of Peptides.Biochem.Biophys.Res.Comm.203(1)1994:244–252.
12. Huang W,et al.Chemoenzymatic Glycoengineering of Intact IgG Antibodies for Gain of Functions.J.Am.Chem.Soc.134(29)2012:12308–12318;doi:10.1021/ja3051266.
13. SoláRJ,Griebenow K.Glycosylation of Therapeutic Proteins.BioDrugs.24(1)2010:9–21;doi:10.2165/11530550-000000000-00000.
14. Trimble RB,Tarentino AL.Identification of Distinct Endoglycosidase(Endo)Activities in Flavobacterium meningosepticum:Endo F1,Endo F2,and Endo F3.Endo F1 and Endo H Hydrolyze Only High Mannose and Hybrid Glycans.J.Biol.Chem.266(3)1991:1646–1651.
15. Tarentino AL,et al.Multiple Endoglycosidase F Activities Expressed By Flavobacterium meningosepticum Endoglycosidases F2 and F3:Molecular Cloning,Primary Sequence,and Enzyme Expression.J.Biol.Chem.268(13)1993:9702–9708.
16. Collin M,Olsén A.Endo S:A Novel Secreted Protein from Streptococcus pyogenes with Endoglycosidase Activity on Human IgG.EMBO J.20(12)2001:3046–3055.
17. Sjögren J,et al.EndoS 2 Is a Unique and Conserved Enzyme of Serotype M49 Group A Streptococcus That Hydrolyses N-Linked Glycans on IgG and1-Acid Glycoprotein.Biochem.J.455(1)2013:107–118;doi:10.1093/emboj/20.12.3046.
18. Mizuochi T,Amano J,Kobata A.New Evidence to the Substrate Specificity of Endo-Beta-N-Acetlylglucosiamindase D.J.Biochem.95(4)2008:1209–1213.
19. Yamamoto K,et al.Novel Specificities of Mucor hiemalis Endo-Beta-N-Acetylglucosaminidase Acting Complex Asparagine-Linked Oligosaccharides.Biosci.Biotechnol.Biochem.58(1)1994:72–77.
这有帮助吗? 是 否 第一个投票!
标签:
葡聚糖 糖基化 天冬氨酸 糖苷酶 蛋白酶
相关产品列表
-
N159659 4-硝基苯基-α-D-吡喃甘露糖苷 ,>98.0%(HPLC)SDS| 价格
-
A329587 Aspterric Acid ,95%SDS| 价格
-
P111001 D-脯氨酸 ,99%SDS| 价格
-
D140060 葡聚糖 ,GPC标准品,Mw,5000SDS| 价格
-
D140043 葡聚糖 ,医药级,符合EP/USP/JP,Mw,40000SDS| 价格
-
D140037 葡聚糖 ,医药级,Mw,110000SDS| 价格
-
D140036 葡聚糖 ,医药级,Mw,10000SDS| 价格
-
D140035 葡聚糖 ,医药级,Mw,1500SDS| 价格
-
D140056 葡聚糖 ,GPC标准品,Mw,150000SDS| 价格
-
D140038 葡聚糖 ,医药级,Mw,150000SDS| 价格
-
D140055 葡聚糖 ,GPC标准品,Mw,12000SDS| 价格
-
D140061 葡聚糖 ,GPC标准品,Mw,50000SDS| 价格
-
D400779 葡聚糖 ,优级品,Mw,500000SDS| 价格
-
D140063 葡聚糖 ,GPC标准品,Mw,80000SDS| 价格
-
D140057 葡聚糖 ,GPC标准品,Mw,25000SDS| 价格
-
D104008 葡聚糖 ,Mw,40000SDS| 价格
-
D140046 葡聚糖 ,医药级,符合EP,Mw,60000SDS| 价格
-
D140042 葡聚糖 ,医药级,Mw,3500SDS| 价格
-
D140054 葡聚糖 ,GPC标准品,Mw,1000SDS| 价格
-
D140058 葡聚糖 ,GPC标准品,Mw,270000SDS| 价格
-
D400784 葡聚糖 ,优级品,Mw,750000SDS| 价格
-
D140045 葡聚糖 ,医药级,Mw,500000SDS| 价格
-
D140051 葡聚糖 ,超纯级,Mw,20000SDS| 价格
-
D140052 葡聚糖 ,超纯级,Mw,40000SDS| 价格
-
D140062 葡聚糖 ,GPC标准品,Mw,670000SDS| 价格
-
D104006 葡聚糖 ,Mw,70000SDS| 价格
-
D104010 葡聚糖 ,Mw,5000SDS| 价格
-
D140048 葡聚糖 ,医药级,Mw,750000SDS| 价格
-
D104012 葡聚糖 ,Mw,20000SDS| 价格
-
D140039 葡聚糖 ,医药级,Mw,20000SDS| 价格
-
D140044 葡聚糖 ,医药级,Mw,5000SDS| 价格
-
D140047 葡聚糖 ,医药级,符合EP/USP/JP,Mw,70000SDS| 价格
-
D140049 葡聚糖 ,Mw,2000000价格
-
D140053 葡聚糖 ,超纯级,Mw,70000SDS| 价格
-
D140059 葡聚糖 ,GPC标准品,Mw,410000SDS| 价格
-
D104005 葡聚糖 ,Mw,10000SDS| 价格
-
D400775 葡聚糖 ,Mw,150000SDS| 价格
-
D400777 葡聚糖 ,Mw,250000SDS| 价格
-
D140041 葡聚糖 ,医药级,Mw,250000SDS| 价格
-
D140040 葡聚糖 ,医药级,Mw,25000SDS| 价格
-
D140034 葡聚糖 ,医药级,符合EP/USP,Mw,1000SDS| 价格
-
D400717 葡聚糖 ,Mw,1500SDS| 价格
-
D400765 葡聚糖 ,Mw,25000SDS| 价格
-
D400769 葡聚糖 ,优级品,Mw,60000SDS| 价格
-
D400719 葡聚糖 ,Mw,3500SDS| 价格
-
F141104 天冬酰胺 ,94%SDS| 价格
-
T100459 D-苏氨酸 ,99%SDS| 价格
-
T108221 L-苏氨酸 ,99%SDS| 价格
-
N389642 N-乙酰半乳糖胺,α1-O-丝氨酸 ,SDS| 价格
-
N355747 N-叠氮基乙酰氨基葡萄糖,乙酰化 ,SDS| 价格
-
P128675 木瓜酶 来源于番木瓜乳液(冻干) ,≥15 units/mg protein,以BAEE为底物SDS| 价格
-
P128674 木瓜酶 来源于番木瓜乳液(悬浮液) ,≥20 units/mg protein,以BAEE为底物SDS| 价格
-
S329534 Sericic acid ,95%SDS| 价格
-
G293642 α-1,4-半乳糖基转移酶 ,95% by SDS-PAGESDS| 价格
-
A109181 α-淀粉酶 ,BRSDS| 价格
-
G128643 β-半乳糖苷酶 来源于大肠杆菌(纯化) ,≥300 units/mg proteinSDS| 价格
-
D401020 葡聚糖 ,超纯级,Mw,10000SDS| 价格
-
D400730 葡聚糖 ,Mw,6000SDS| 价格
-
D406300 葡聚糖 ,优级品,Mw,110000SDS| 价格
-
D401022 葡聚糖 ,超纯级,Mw,500000SDS| 价格
-
D400713 葡聚糖 ,优级品,Mw,1000SDS| 价格
-
P420186 PNGase F ,>25 U/mgSDS| 价格

 订购客服热线
订购客服热线











 营业执照(三证合一)
营业执照(三证合一)  危险品化学品经营许可证(不带存储)
危险品化学品经营许可证(不带存储)