PEG-N3与炔基的生物正交和点击化学
生物正交化学简介
生物正交化学是指在不影响生物分子或干扰生化过程的情况下,在生物环境中发生的一系列反应。为达到此目的,反应必须满足快速、高效和特异性的要求。
• pH值:反应必须在生理环境的温度和pH值下发生;
• 精准:反应必须具有选择性并且高效得到目标产品,且须不受水或内源性亲核试剂、亲电试剂、还原剂或复杂生物环境中氧化剂的影响;
• 快速:即便在低浓度下,反应也必须是快速的,并且须生成稳定的反应产物;
• 特异性:反应应涉及生物系统中非天然存在的官能团。
生物正交反应的优点和缺点
|
生物正交反应
|
优点
|
缺点
|
|
Staudinger
连接反应
|
叠氮化物和膦化物具有生物相容性,生成的产物是以稳定的酰胺键连接的。
|
反应速度慢,磷化氢容易被氧化。
|
|
CuAAC(叠氮+炔基)
|
反应迅速,在20 μM Cu(I)的催化下k值可达~10-100(M-1S-1);具有良好的区域选择性。
|
尽管有些配体如THPTA比较稳定,但是铜催化剂的铜毒性仍需考虑在内。
|
|
SPAAC(叠氮+DBCO)
|
无需铜催化,k值约~1-60 (M-1S-1)。
|
1. 反应慢于CuAAC,大块的环状砌块难以融入生物分子;
2. 所需溶剂:10%-40%的乙醇溶液或DMSO(至多60%)/PBS缓冲液;
3. pH < 5.5时反应速度会变慢,因为在此pH下DBCO的稳定性会降低;
4. 巯基、叠氮化钠都会与DBCO发生反应。
|
|
IEDDA (TCO + Tz)
|
反应非常迅速,k值约~1-106 (M-1S-1)
|
TCO在含水环境中稳定性差。
|
• CuAAC:铜催化的叠氮-炔基环加
• SPAAC:叠氮-烷烃环化加成反应
• IEDDA:逆电子需求的D-A反应。
表1:各类生物正交反应的优缺点小结表
叠氮-炔基点击化学简介
经典的点击化学反应会用到铜作为催化剂,一般是一价铜催化1,3-偶极环加成炔和叠氮化物形成1,2,3-三唑[1,2]。一价铜的来源包括碘化铜、溴化铜、
铜屑或硫酸铜与还原剂发生反应生成的产物[3]。然而,一价铜具有热力学不稳定性,容易被氧化成无活性的二价铜,通常需要铜催化剂与合适的螯合配体共同制备。
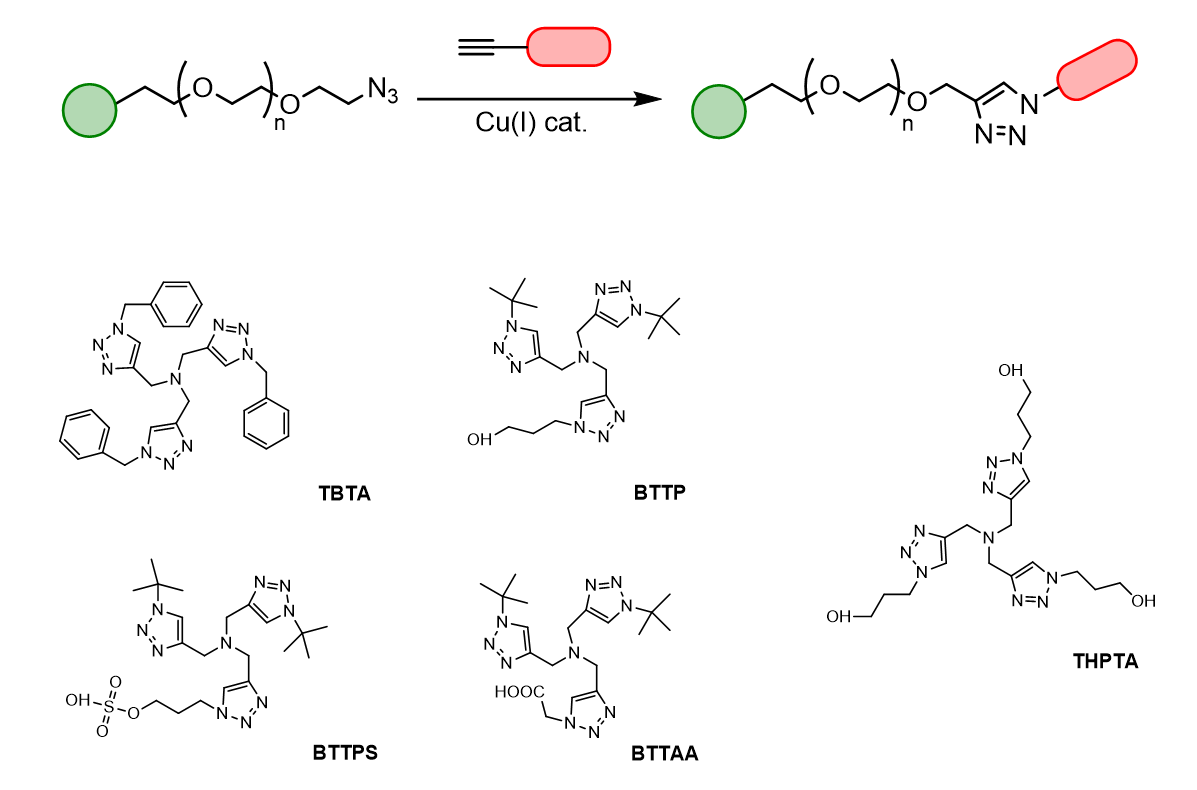
优化后的点击化学反应是使用了用抗坏血酸钠和一价铜稳定的配体三(苄基三唑基甲基)胺(TBTA)还原硫酸铜来原位制备一价铜Cu(I)。通过这个方法,可以避免溶解氧氧化催化一价铜,因此能够使得点击化学反应更为有效。在典型的点击化学中,硫酸铜是与TBTA预络合的,现将这种复合催化剂与炔和叠氮化物混合,随后再加入抗坏血酸钠来引发点击反应。
TBTA覆盖了在点击化学领域的大量实际应用,除了含水环境下的共轭反应。而水溶性的THPTA点击配体则可以适用于水相反应,进一步简化点击化学步骤,为点击化学反应提供具生物相容性的THPTA配体来结合Cu(I),阻断Cu(I)的生物利用度,改善其潜在的毒性作用,保持催化效率
[4]。同时THPTA配体可以有效地被用于高效标记活细胞,并维持细胞活性[5]。
我们发现THPTA在水相反应中是一种高效的点击化学配体,它的标记反应在室温下往往只需要15-30分钟即可完成。在冷冻条件下储存,配体CuSO4
复合物在至少一个月后仍能保持原有的活性。
实操案例
寡核苷酸类和DNA的标记
1. 配制以下原液:
• 200 mM THPTA配体的水溶液
• 100 mM硫酸铜水溶液
• 炔基标记的水相寡聚物
• 100 mM抗坏血酸钠水溶液
• 10 mM在DMSO/叔丁醇或水中的含叠氮化合物
2. 在反应前将硫酸铜和THPTA配体以1:2的当量比混合静置几分钟,这样的溶液在冷冻后可以稳定储存数周;
3. 向寡聚糖/DNA溶液中添加过量4~50倍当量的叠氮化物(如PEG-N3等);
4. 添加25当量的THPTA/CuSO4;
5. 添加40当量的抗坏血酸钠;
6. 在室温下静置反应30~60分钟;
7. 在乙醇中沉淀纯化寡聚物。
细胞裂解物的标记
1. 配制以下原液:
• 100 mM THPTA配体的水溶液或缓冲溶液
• 20 mM硫酸铜水溶液
• 300 mM抗坏血酸钠水溶液
• 2.5 mM在水或DMSO中的炔基或叠氮标记试剂
2. 对每个叠氮化物或炔基修饰的蛋白质裂解物样品,添加以下物质至1.5 mL的离心管中,然后简单涡旋混合:
• 50 µL存放于蛋白质萃取缓冲液中的蛋白质裂解产物(1-5 mg/mL)
• 90 µL PBS缓冲液
• 20 µL在水中或DMSO中2.5 mM相应叠氮化物(或含炔基化合物)的检测试剂
3. 加入10 µL的100 mM THPTA溶液并简单涡旋混合;
4. 加入10 µL的20 mM硫酸铜溶液并简单涡旋混合;
5. 加入10 µL的300 mM 抗坏血酸钠溶液来引发点击化学反应并简单涡旋混合;
6. 保护反应避光,并在室温下反应30分钟;
7. 现在在裂解物中的蛋白质已通过点击化学反应被标记了,可以进行下一步的处理和分析了。
铜催化的炔基-叠氮化物点击化学标记活细胞

图1:(上图)细胞标记的步骤
(下图)炔基探针试剂和催化剂添加剂
叠氮聚糖在HeLa和CHO细胞表面的标记及共聚焦显微镜成像
将细胞以1 × 105个/mL的浓度置于35 mm玻璃底培养皿中培育,并在含有或不含50 μM Ac4ManNAz的生长培养基(含10%胎牛血清、1%谷氨酰胺和1%青链霉素溶液的MEM培养基)中在37 ℃和5% CO2的条件下过夜反应。轻轻地抽吸培养基将多余的溶液移除,用1 mL DPBS洗涤细胞2次。在微量离心管中,4 ℃下以1:5的摩尔当量比将硫酸铜和THPTA添加到含有染料-1炔基或2炔基(浓度:25 μM)的DPBS和氨基胍(浓度:1 mM)中。配制新鲜制备的抗坏血酸钠原液(100 mM)便于后续配制最终浓度为2.5 mM的抗坏血酸钠溶液。将该反应混合物在4 ℃条件下冰浴保温10分钟,然后添加到细胞中。将此混合物再次在4 ℃保温5分钟之后,洗涤细胞,室温下用3%多聚甲醛、0.3%戊二醛和1 mM的氯化镁混合溶液在DBPS中固定10分钟。加入4', 6-二脒基-2-苯基吲哚(DAPI)对细胞核进行染色,并在每一步之间,用DPBS冲洗玻片3次,玻片采用Vecta Shield介质来安装;使用Bio-Rad 2100共聚焦显微镜和60×的油镜来进行切片成像,用ImageJ(http://rsbweb.nih.gov/ij/)来分析和处理得到的数据及图片。对于双标记的实验,在标记反应后,用1 mL的生长培养基洗涤细胞两次,然后重新置于含有50 μM的Ac4ManNAz的培养基放置继续培育20 小时。细胞表面标记的最佳条件为在4 ℃的培养基中,用25 μM的炔基化合物溶液、硫酸铜溶液(50 μM)、THPTA (250 μM)、氨基胍(1 mM)和抗坏血酸钠(2.5 mM)标记1-5分钟。
参考文献
1. Polytriazoles as Copper(I)-Stabilizing Ligands in Catalysis; T. R. Chan, R. Hilgraf, K. B. Sharpless, V. V. Fokin, Org. Lett. 2004, 6, 2858. https://pubs.acs.org/doi/10.1021/ol0493094
2. Analysis and Optimization of Copper-Catalyzed Azide–Alkyne Cycloaddition for Bioconjugation; V. Hong, S. I. Presolski, C. Ma, M. G. Finn, Angew. Chem. Int. Ed. 2009, 48, 9879. https://onlinelibrary.wiley.com/doi/10.1002/ange.200905087
3. Stabilization of Virus-like Particles with Poly(2-oxazoline)s; F. Manzenrieder, R. Luxenhofer, M. Retzlaff, R. Jordan, M. G. Finn, Angew. Chem. Int. Ed. 2011, 50, 2601. https://onlinelibrary.wiley.com/doi/10.1002/ange.201006134
4. Synthesis of Cyclic Peptide Disulfide–PHPMA Conjugates via Sequential Active Ester Aminolysis and CuAAC Coupling; K. A. Günay, H. Klok, Polym. Chem. 2016, 7, 970. https://pubs.rsc.org/en/content/articlelanding/2016/py/c5py01817j
5. Cellular Consequences of Copper Complexes used to Catalyze Bioorthogonal Click Reactions; D. C. Kennedy, C. S. McKay, M. C. B. Legault, D. C. Danielson, J. A. Blake, A. F. Pegoraro, A. Stolow, Z. Mester, J. P. Pezacki, J. Am. Chem. Soc. 2011, 133, 17993. https://pubs.acs.org/doi/10.1021/ja2083027
这有帮助吗? 是 否 第一个投票!
标签:
聚乙二醇(PEG) 生物正交化学 叠氮炔烃点击化学 材料科学 生物医学材料
相关产品列表
-
B122224 (+)-生物素-PEG2-叠氮化物 ,98%SDS| 价格
-
A163304 Azido PEG NHS, N3-PEG-NHS ,MW 5000 DaSDS| 价格
-
A163308 叠氮 PEG 巯基, N3-PEG-SH ,MW 3400 DaSDS| 价格
-
A163279 叠氮-PEG-胺,N3-PEG-NH2 ,95%,MW 10000 DaSDS| 价格
-
A163292 Azido PEG hydroxyl, N3-PEG-OH ,MW 2000 DaSDS| 价格
-
A163313 Azido PEG, mPEG-N3 ,95%,MW 2000 DaSDS| 价格
-
A163314 Azido PEG, mPEG-N3 ,95%,MW 20000 DaSDS| 价格
-
A163317 叠氮 PEG, mPEG-N3 ,MW 40000 DaSDS| 价格
-
A163316 叠氮 PEG, mPEG-N3 ,MW 350 DaSDS| 价格
-
A163315 叠氮 PEG, mPEG-N3 ,MW 30000 DaSDS| 价格
-
A163312 Azido PEG, mPEG-N3 ,95%,MW 10000 DaSDS| 价格
-
A163311 Azido PEG, mPEG-N3 ,95%, MW 1000 DaSDS| 价格
-
A166185 叠氮基PEG12-酸 ,95%SDS| 价格
-
A305020 叠氮-PEG4-NHS酯 ,95%SDS| 价格
-
B171421 Biotin PEG3 azide ,95%SDS| 价格
-
B122225 生物素-PEG3-叠氮化物 ,95%SDS| 价格
-
B152153 生物素-PEG₄-叠氮 ,>96.0%(HPLC)SDS| 价格
-
H163764 HO-PEG4-Azide ,95%SDS| 价格
-
S164289 硅烷-PEG-N3, 硅烷 PEG 叠氮 ,MW 5000 DaSDS| 价格

 订购客服热线
订购客服热线








 危险品化学品经营许可证(不带存储)
危险品化学品经营许可证(不带存储) 
